Se enunció: “Las propiedades físicas y químicas de los elementos son funciones periódicas de los números atómicos”.
- Es decir los elementos están ordenados en función creciente de sus números atómicos.
- La tabla periódica actual (forma larga) fue diseñada por Werner y es una modificación de la tabla de Mendeleiev.
Descripción: Los elementos se hallan distribuidos:
- En 7 filas denominadas (periodos).
- En 18 columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.

PERIODOS: Son las filas horizontales, nos indican el último nivel de energía del elemento. Existen 7 periodos o niveles.
- Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos respectivamente, son denominados Periodos cortos.
- Periodos 4, 5 y 6 son los Periodos largos, el 7º periodo se halla incompleto.
- Los elementos cuyos números atómicos se hallan comprendidos entre el La (Z= 57) y el Lu (Z= 71) se llaman Lantánidos.
- Los elementos con número atómico superior al Ac (Z= 89) se denominan Actínidos.
- Ellos se encuentran separados en 2 filas de la tabla periódica, con el objeto de no extender demasiado la figura.
- Los elementos después del Uranio (Z= 92) se han obtenido en forma artificial del uranio, denominándose a éstos Trans uránicos.
GRUPOS O FAMILIAS: Son agrupaciones verticales, que nos indican que poseen propiedades químicas semejantes, debido a que poseen los mismos electrones de valencia.
En la tabla periódica están ordenados en grupos A y B.
a) GRUPO A:
- Están situados en los extremos de la tabla periódica.
- Nos indican el número de electrones de la última capa y se representan en números romanos.
- Terminan en el subnivel “s” y “p”

a) GRUPO B:
- Están situados en la zona central de la tabla periódica.
- El número de electrones de la última capa, no nos indica el grupo; debido a que la valencia es variable.
- La configuración electrónica termina en el subnivel “d”.
- Los elementos de transición interna, llamados tierras raras: su configuración electrónica termina en “f”.
Tienen 8 subgrupos. El grupo VIII B tiene 3 casilleros. 

Clasificación de los elementos químicos
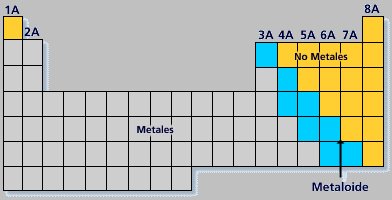
Los elementos químicos se pueden clasificar en: Metales, no metales, metaloides (anfóteros) y gases nobles.
Metales:
- Son buenos conductores del calor y la electricidad.
- Se oxidan (pierden electrones).
- Se les denomina también reductores.
- Son electropositivos.
- Son sólidos a excepción del mercurio (líquido a temperatura ambiente).
No metales:
- Son malos conductores del calor y la electricidad.
- Se reducen (ganan electrones).
- Se les denomina también oxidantes.
- Son electronegativos.
- La mayoría a temperatura ambiente se encuentran en estado sólido. Como gases están N, O, F, Cl, H y en estado líquido el Br.
Metaloides o anfóteros:
Son elementos que tienen propiedades metálicas y no metálicas. Ocupan una región diagonal que se observa en la tabla periódica (transición entre metal y no metal); entre ellos podemos encontrar al B, Si, Ge, As, Sb, Te, Po.
Gases nobles:
- Son elementos químicamente estables por tener su última capa 8 e- a excepción del He que tiene 2 y se representan.
n s2 p6 - No se combinan con ningún otro elemento. Sólo a temperaturas exigentes el Xe puede reaccionar.
- Sus moléculas son monoatómicas.
De acuerdo a su configuración electrónica, los elementos químicos se clasifican en: gases nobles, elementos representativos y elementos de transición.
1. Gases nobles: Son los que se ubican en el extremo derecho de la tabla periódica, en el grupo 0, u VIII A (también 18). Los átomos de estos gases, con excepción del helio, tienen 8 electrones de valencia. Esto significa que el último nivel de energía tiene sus orbitales completos (8 e-), distribuidos según la configuración n s2 p6. Donde "n" representa el nivel de energía más externo.
2. Elementos representativos: Se ubican en los grupos A de la tabla periódica. Estos elementos tienen sus electrones de valencia en los orbitales "s" o "p" y sus configuraciones externas van desde n s1 hasta n s2 p5, excluyendo al 1s2 (helio que corresponde a un gas noble).
3. Elementos de transición: Se sitúan en los grupos B de la tabla periódica. Sus átomos presentan configuraciones más complejas; los electrones de valencia se encuentran en los orbitales "d" o "f".
No hay comentarios:
Publicar un comentario